Definisi
Endokarditis Infektif adalah
suatu kelainan yang disebabkan infeksi oleh mikroorganisme tertentu yang
terjadi pada jaringan permukaan endotel jantung atau katup jantung, sering
disebut juga endokarditis bakterialis. Katup jantung adalah yang paling sering
terkena akan tetapi infeksi dapat
terjadi pada lokasi septal defect atau pada korda tendinae atau pada endokardium.
Endokarditis infektif (EI) tidak hanya terdapat pada katub yang mengalami kerusakan akan tetapi pada katub yang sehat misalnya: endokarditis yang terjadi pada penyalahgunaan narkotik intravena, dan dapat pula terjadi pada katup buatan atau bioprostetik. Penyakit yang secara klinis dan patologi mirip dengan endokarditis infektif adalah endoarteritis (infeksi pada lapisan dalam arteri) seperti infeksi arteriovenous shunt, arteriarterial shunt (patent ductus arteriosus) atau koarktasio aorta Cirinya antara lain lesi yang khas, vegetasi, berupa massa trombosit dan fibrin dengan berbagai bentuk dan ukuran dimana banyak mikroorganisme dan sel-sel radang di dalamnya.
Endokarditis infektif (EI) tidak hanya terdapat pada katub yang mengalami kerusakan akan tetapi pada katub yang sehat misalnya: endokarditis yang terjadi pada penyalahgunaan narkotik intravena, dan dapat pula terjadi pada katup buatan atau bioprostetik. Penyakit yang secara klinis dan patologi mirip dengan endokarditis infektif adalah endoarteritis (infeksi pada lapisan dalam arteri) seperti infeksi arteriovenous shunt, arteriarterial shunt (patent ductus arteriosus) atau koarktasio aorta Cirinya antara lain lesi yang khas, vegetasi, berupa massa trombosit dan fibrin dengan berbagai bentuk dan ukuran dimana banyak mikroorganisme dan sel-sel radang di dalamnya.
 |
| Ilustrasi Endokarditis Infektif |
Sejarah pengetahuan EI dapat dibagi
menjadi beberapa era. Pada tahun 1674, Lazaire Riviere pertamakali
mendeskripsikan penemuan autopsinya pada karya ilmiahnya Opera medica
universa . Pada
tahun 1885, William Osler mempresentasikan yang untuk pertamakalinya secara
komprehensif tentang endokarditis di inggris. Lerner dan Weinstein
mempresentasikan melalui diskusi yang cukup lengkap mengenai penyakit ini di
masa modern dalam beberapa artikel terkenalnya , “Infective Endocarditis in the Antibiotic
Era,” yang dipublikasikan di New England Journal of Medicine pada tahun 1966.
Perjalanan penyakit ini bisa hiperakut, akut, sub akut, atau kronik
bergantung pada virulensi mikroorganisme dan imunitas pasien.
EI akut, apabila masa inkubasinya berlangsung kurang
dari empat minggu. Endokarditis bakterialis subakut/ kronis, berlangsung lebih dari 4
minggu, kadang disebut Endokarditis bakterialis lenta atau special lenta. Endokarditis infektif akut ditandai oleh toksisitas yang
tinggi dan berkembang dalam bebeapa hari
sampai beberapa minggu yang
menimbulkan kerusakan katup dan infeksi metastatik sebaliknya endokarditis
subakut berkembang selama beberapa minggu sampai beberapa bulan dengan toksisitas yang sedang dan jarang menimbulkan infeksi metstatik. Endokarditis infektif akut terutama
disebabkan oleh Stafilokokkus aureus akan tetapi tidak selalu demikian,
sedangkan nedokarditis subakut lebih sering disebabkan oleh streptokkokkus viridians, enterokokkus, stafilokokkus negative-koagulase, atau kokkobasil gram negatif.
Endokarditis infektif sub akut hampir selalu fatal
dalam beberapa bulan sampai dua tahun, sedangkan endokarditis hiperakut dan
akut hampir tak dikenal, karena pasien telah meninggal dunia lebih dahulu
disebabkan oleh sepsis, sebelum gejala klinis yang terkena infeksi timbul,
walapun pada autopsis jelas terlihat vegetasi infeksi pada endokard dan katub
jantung. Endokarditis infektif kronik hampir tak dapat dibuat diagnosisnya
sewaktu pasien masih hidup karena gejala khas tidak ditemukan hanya
gejala-gejala infeksi saja.
Etiologi
Jenis Endokarditis Infektif yang
berbeda memiliki penyebab yang beragam dan melibatkan patogen yang berbeda
pula. Mikroorganisme yang dapat menimbulkan penyakit ini paling banyak adalah Streptococcus
viridans untuk endokarditis subakut, dan Staphylococcus aureus untuk
endokarditis infektif akut. Etiologi lain adalah Streptococcus faecalis, streptokok
dan stafilokok lain, bakteri Gram negatif aerob dan anaerob, jamur, virus, dan
kandida. Faktor predisposisi EI adalah kelainan katup jantung, terutama penyakit jantung reumatik, katup aorta
bikuspid, prolaps katup mitral dengan regurgitasi, katup buatan, katup yang floppy
pada sindrom Marfan, tindakan bedah gigi atau orofaring yang baru, tindakan
atau pembedahan pada saluran urogenital atau saluran napas, pecandu narkotika
intravena, kelainan jantung bawaan, luka
bakar, hemodialisa, penggunaan kateter vena sentral, dan pemberian
nutrisi parenteral yang lama.
Pembagian
penyebab bisa juga berdasarkan jenis katup dan kondisi tertentu seperti :
Endokarditis
Pada Katup Buatan
Pada tahap awal endokarditis ini,
(biasanya setelah pembedahan) , memiliki gambaran bakteriologis dan prognosis
yang berbeda dengan endokarditis pada katup buatan tahap akhir, yang mirip
dengan gambaran endokarditis subakut pada katup asli (alami / bukan
buatan).
Infeksi yang terjadi pada katup
buatan biasanya berhubungan dengan abses lokal, pembentukan fistula, atau luka
operasi yang membuka kembali ( eviscerasi / dishiscence ). Hal ini dapat
mengakibatkan syok, gagal jantung, block jantung, pengalihan darah menuju
atrium kanan, tamponade perikardium, dan emboli perifer ke sistem saraf pusat
atau tempat lainnya.
Endokarditis katup buatan tahap awal dapat
disebabkan oleh beberapa macam patogen, antara lain Staphylococcus aureus dan Staphylococcus
epidermidis. Mikroorganisme
nosokomial ini biasanya resisten terhadap methicillin (MRSA). Endokarditis katup
buatan tahap akhir biasanya disebabkan oleh streptococci Late disease is most
commonly caused by streptococci. Secara keseluruhan Coagulase-Negative Staphylococcus adalah penyebab tersering
Endokarditis pada katup prostetik (30%). Staphylococcus aureus menyebabkan 17% Endokarditis katup buatan
tahap awal dan 12% tahap akhir. Corynebacterium, nonenterococcal
streptococci, fungi (Candida albicans, Candida stellatoidea, Aspergillus
species), Legionella, Haemophilus aphrophilus, Actinobacillus
actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella
kingae) merupakan mikroorganisme penyebab endokarditis katup buatan lainnya.
Endokarditis
pada katup asli
Beberapa
penyebab utama endokarditis pada katup alami antara lain :
- Penyakit Rematik Katup (30% dari
kasus) utamanya melibatkan katup mitral diikuti oleh katup aorta.
- Penyakit Jantung kongenital (15%
dari kasus) antara lain patent
ductus arteriosus ventricular
septal defect (VSD), tetralogi Fallot, atau lesi bawaan atau lesi bedah
beraliran tinggi.
- Prolaps katup mitral dengan murmur
(pada 20% kasus)
- Penyakit Jantung degeneratif,
termasuk di dalamnya stenosis aorta terkalsifikasi dikarenakan katup
bikuspid, sindroma Marfan, atau penyakit sifilitik.
Sekitar 70% dari
infeksi endokarditis jenis ini disebabkan oleh Streptococcus sp,
termasuk Streptococcus viridans, Streptococcus bovis, dan enterococci. Staphylococcus
species menjadi pnyebab pada 25% dari kasus endokarditis tipe biasanya
menunjukkan manisfestasi akut yang lebih agresif.
Endokarditis
Infektif pada Penyalahgunaan Narkoba Intravena
Penegakan diagnosis untuk
endokarditis pada penyalahgunaaan obat melalui intravena biasanya sulit dan butuh
tingkat kejelian yang tinggi. Dua dari tiga pasien tidak memiliki riwayat
terdahulu akan adanya penyakit jantung atau penemuan murmur pada pemeriksaan
sebelumnya. Murmur dapat tidak ditemukan pada pasien dengan penyakit trikuspid,
yang disebabkan pressure gradient yang
relatif kecil pada katup tersebut. Gejala paru sering ditemukan pada pasien
dengan infeksi trikuspid, sepertiga kasus memiliki nyeri dada pluera, dan 75%
kasus menunjukkan kelainan radiologis pada dada.
Staphylococcus aureus adalah penyebab paling umum (< 50% kasus) pada
pasien endokarditis jenis ini. Penemuan MRSA meningkat pada infeksi S. Aureus dan biasanya berhubungan
dengan riwayat opname sebelumnya, kecanduan jangka panjang, dan penggunaan
antibiotik yang tidak sesuai resep. Streptococci
dan enterococci grup A, C dan G juga ditemukan pada pasien endokarditis tipe
ini. Akhir-akhir ini kuman gram negatif juga menjadi penyebab namun lebih jarang, contohnya P. aeruginosa dan kuman kelompok HACEK (Haemophilus
aphrophilus, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis,
Eikenella corrodens, Kingella kingae).
Endokarditis
Infektif Nosokomial
Penanganan endocarditis tertentu
biasanya dilakukan dengan pendekatan metode-metode terbaru yang melibatkan
peralatan intravaskuler seperti kateter intravena perifer, alat pacu irama
jantung seperti pacemaker ,
defibrillator, kateter dan shunt hemodialysis, terapi obat dan makanan melalui hyperalimentation.
Pasien yang terindikasi melakukan prosedur-prosedur ini biasanya memiliki
penyakit penyerta yang signifikan, umur yang lebih lanjut, dan mudah terpapar
infeksi S. aureus . Angka kematian pada pasien kelompok ini
tinggi.
Mikroorgansime yang paling umum
menyebabkan endokarditis infektif nosokomial (endokarditis yang terjadi saat
pengobatan pada fasilitas pelayanan kesehatan) adalah kuman coccus gram positif
(S aureus, Coagulase-Negative Staphylococcus, enterococci, streptococci
nonenterococcal).
Fungi
(Jamur)
Fungal endocarditis biasanya
ditemukan pada penyalahguna obat melalui intravena (suntikan) dan pasien ICU (intensive
care unit) yang menerima antibiotik spektrum luas. Kultur darah biasanya
negatif, dan diagnosis kadangkala terjadi pada saat pemeriksaan mikroskopis
dari emboli yang besar. Biasanya pada kasus EI subakut. Fungi yang paling umum
menyebabkan EI dan mengenai baik katup buatan maupun katup alami adalah Candida
albicans. Fungi yang ditemukan
pada Endokarditis Infektif Penyalahgunaan obat Intravena biasanya adalah Candida
parapsilosis or Candida tropicalis. Aspergillus
species juga ditemukan pada EI katup buatan dan EI nosokomial.
Faktor
Risiko Endokarditis Infektif
Prinsip faktor risiko ini adalah
dengan dasar pertimbangan bahwa pada individu yang sehat, bakteremia (kuman
yang masuk ke aliran darah) dapat secara cepat tertangani tanpa dampak yang
merugikan. Walaupun demikian, jika suatu katup jantung mengalami kerusakan ,
bakteri dapat menempel pada katup tersebut, yang akhirnya menyebabkan EI.
Sebagai tambahan, seorang pasien dengan sistem imun yang melemah, konsentrasi
bakteri dalam darah dapat mencapai level yang cukup tinggi untuk meningkatkan
kemungkinan beberapa menempel pada katup.
Beberapa faktor risiko signifikan seperti di bawah ini :
- Katup jantung buatan
- Alat di dalam jantung
(Intracardiac) seperti pacemaker,
Implantable
cardioverter-defibrillators
- Kelainan jantung sianotik
kongenital yang belum
- Riwayat endokarditis infektif
- Penyakit jantung rematik kronik
yang merupakan respon autoimun terhadap infeksi Streptococcus pyogenes
berulang
- Lesi valvular degeneratif yang
berhubungan dengan umur
- Hemodialysis (cuci darah)
- Kondisi yang menyebabkan sistem
imun menurun seperti diabetes mellitus, alkoholik, HIV/AIDS dan
penyalahgunaan obat intravena.
Keadaan lain yang menyebabkan
bakteri dengan jumlah yang tinggi memasuki lairan darah antara lain kanker
kolorektal (paling banyak Streptococcus
bovis), infeksi saluran kemih berat (paling banyak enterococci) dan injeksi
obat (Staphylococcus aureus). Dengan jumlah bakteri yang sangat tinggi,
atau bakteri yang memiliki virulensi tinggi seperti S aureus sebuah katup jantung yang sehat dan normal pun dapat
terinfeksi .
Pengguna obat-obatan yang disuntik
(intravenous) lebih cenderung mendapatkan infeksi pada katup-katup jantung
sebelah kanan karena vena yang diinjeksi masuk ke jantung bagian kanan. Pada
penyakit jantung rematik, infeksi terjadi pada katup aorta dan mitral pada
jantung bagian kiri. Faktor risiko lain untuk meningkatkan kemungkinan
terjadinya endokarditis infekstif adalah kadar sel darah putih yang rendah,
immunodefisiensi, immunosupresi, dan keganasan.
Tindakan
dokter gigi
Prosedur-prosedur yang dilakukan
oleh dokter gigi (biasanya karena Streptococcus
viridans, yang tinggal di dalam rongga mulut) seperti pembersihan karang
gigi, ekstraksi (pencabutan) gigi dan lain-lain sebaiknya pasien dikonfirmasi
sebelumnya apakah memiliki kelainan pada jantung. Antibiotik diberikan pada
pasien dengan kelainan jantung sebagai pencegahan, walaupun praktek ini tidak
lagi dilakukan di amerika serikat sejak dikeluarkannya panduan oleh American
Heart Association pada tahun 2007, dan di Inggris pada maret 2008 berdasarkan panduan
pedoman NICE.
Epidemiologi
Insiden Endokarditis Infektif (EI)
relatif stabil dari tahun 1950 sampai
1987 angka kejadiannya kira-kira 4,2 per
100.000 pasien per tahun. Pada awal
tahun 1980 insiden EI setiap tahun per 100.000 populasi adalah 2,0 di United Kingdom dan Wales, dan 1,9
di Netherland. Insiden yang tinggi terjadi dari tahun 1984
sampai 1999. 5,9 dan 11,6 kasus per 100.000 populasi dilaporkan dari Sweden dan
Philadelphia. Injeksi obat-obat terlarang menjadi penyebab setengah dari seluruh
kasus di Philadelphia. EI biasanya terjadi lebih sering pada laki-laki; Rasio
jenis kelaminnya adalah 1,6:2,5. Insiden berdasarkan umur meningkat secara
progresif pada usia lebih dari 30 tahun
dan melebihi dari 14,5 sampai 30 kasus per 100,000 orang pertahun pada orang yang berusia usia 60 tahun sampai
usia 80 tahun. Dari 36 sampai 75 persen pasien endokarditis katup mempunyai
kondisi predisposisi : penyakit jantung
rematik, penyakit jantung bawaan, prolaps katup mitral, penyakit jantung degenerative, hipertrofi septal asimetrik, atau suntikan obat terlarang intravena. Dari
7 sampai 25 persen kasus mengenai katup prostetik. Kondisi predisposisi tidak dapat
diidentifikasi pada 25 sampai 47 persen pasien. Sifat dari kondisi predisposisi
dan mikrobiologi Endokarditis Infektif berkorelasi dengan pasien.
Median usia pasien perlahan-lahan meningkat dari 30
sampai 40 tahun di era sebelum ditemukan antibiotik dan di awal era antibiotik menjadi 47-69 tahun. Demam rematik
yang menjadi penyebab penyakit jantung rematik pada anak dan orang dewasa muda
sudah sangat menurun jumlahnya di Negara yang maju. Penyakit katup jantung yang
didapat muncul sebagai resiko EI dengan semakin
panjangnya usia harapan hidup. Selain itu, di usia-usia akhir kehidupan, banyak
pasien yang memerlukan pembedahan penggantian katup (valve
replacement) yang menempatkan mereka
berisiko mengalami endokarditis. Semakin bertambahnya usia
harapan hidup pada penduduk juga memunculkan penyakit jantung degeneratif sebagai faktor risiko EI.
Akhirnya, endokarditis nosokomial (endokarditis yang
didapat pada saat perawatan di fasilitas kesehatan) meningkat pada orang usia tua dimana mereka banyak
masuk rumah sakit untuk dirawat karena penyakit tersebut.
Kelompok
Umur Pasien
Pasien
anak-anak
Insiden EI di kalangan anak-anak yang dirawat di rumah
sakit berkisar antara 1 diantara 1500 sampai 1 diantara 1280 pasien. Di Netherland, endokarditis infektif ditemukan 1,7 dan 1,2 per 100.000 anak laki-laki dan anak
perempuan yang berusia di bawah 10 tahun. Endokarditis infektif juga ditemukan pada neonatus dan frekuensinya
semakin meningkat. Diantara neonatus, endokarditis infektif biasanya mengenai katup trikuspid pada jantung yang normal dan menimbulkan
kematian yang cukup tinggi. Kemungkinan
sebagian besar episode infeksi tersebut
timbul karena kateter intravena
dan kateter jantung kanan yang terinfeksi serta pembedahan jantung.
Sebagian
besar anak yang menderita EI yang terjadi setelah masa neonatus disebabkan oleh kelainan struktural
jantung. Pada beberapa seri
penelitian penyakit jantung rematik, jarang menjadi predisposisi endokarditis
infektif (≤ 4 persen). Kelainan jantung bawaan khususnya yang melibatkan katup
aorta, ventricular septal defect, tetralogy of Fallot, dan kelainan jantung sianotik lainnya ditemukan pada 75
sampai 90 persen kasus. Dari anak-anak
yang mengalami endokarditis infektif
pada defek kongenital 50 persen mengalami infeksi setelah
pembedahan jantung. Pada anak-anak tersebut infeksi seringkali mengenai katup
prostetik (katup buatan), valve conduit (konduktor katup), atau synthetic patch
(penambal katup sintetik). Septal atrial defect sekunder (bukan bawaan) tidak
berkaitan dengan resiko EI, juga patent ductus arteriosus atau stenosis
pulmonal yang sudah direparasi.
Sejak
tahun 1990, prolaps katup mitral dikenal
menjadi predisposisi EI pada anak-anak.
Hal tersebut biasanya terjadi
jika prolaps disertai murmur regurgitasi, dan merupakan kelainan jantung yang
menjadi pemicu pada 15 persen dan 5 persen kasus pada dua seri penelitian
yang pernah dilaporkan.
Gambaran
klinis EI pada anak-anak sama dengan gambaran klinik endokarditis katup pada
orang dewasa dan hasil ekokardiografnya sama dengan endokarditis katup
prostetik pada orang dewasa.
Pasien
dewasa
Prolaps
katup mitral muncul sebagai factor
pemicu utama kelainan jantung structural dan pada orang dewasa menjadi penyebab
7 sampai 30 persen endokarditis katup pada kasus yang tidak berkaitan dengan
penyalahgunaan obat atau infeksi nosokomial. Prolaps katup mitral pada EI
bukan merupakan cerminan langsung resiko EI tetapi agaknya karena
prolaps katup mitral kejadiannya memang tinggi dalam suatu penelitian yang
berbasis komunitas yaitu sekitar 2,4 persen.
Risiko relatif endokarditis infektif di
kalangan pasien dewasa penderita prolaps katup mitral berkisar antara 3,5 sampai 8,2. Risiko endokarditis pada orang dewasa adalah prolaps
katup, penebalan daun katup (>5 mm)
dan murmur regurgitasi mitral.
Risiko juga meningkat di kalangan laki-laki dan pasien yang berusia lebih dari 45 tahun.
Dikalangan pasien prolaps katup mitral yang disertai murmur sistol, insiden
endokarditis infective adalah 52 per 100.000 orang pertahun dibanding dengan angka 4,6 per
100.000 orang pertahun pada penderita prolaps katup tanpa murmur.
Mikrobiologi
EI yang disertai prolaps katup mitral sama dengan mikrobiologi yang ditemukan
pada endokarditis katup.
Pasien
Penyalahgunaan Obat Intravena
Risiko EI di
kalangan pemakai obat terlarang adalah 2 sampai 5 persen per pasien pertahun
yaitu beberapa kali lebih tinggi
daripada pasien penyakit jantung rematik atau pasien yang menggunakan katup
prostetik. Pada suatu penelitian, EI didiagnosa pada 74 (6,4 persen) dari 1150
pecandu obat intravena yang dirawat dalam kurun waktu 12 bulan. Di Philadelphia, 5,3 dari total 11,6 kasus EI
per 100.000 penduduk disebabkan oleh injeksi obat terlarang.
Dari 65 sampai 80 persen kasus EI
pada kasus tersebut mengenai laki-laki
yang berusia 27 sampai 37 tahun
EI yang terjadi pada pecandu obat mempunyai
kecenderungan unik menginfeksi katup jantung kanan. Pada sebuah seri hasil penelitian klinis,
distribusi keterlibatan katup jantung adalah trikuspid : 46 sampai 78 persen, katup mitral
: 24 sampai 32 persen, dan
katup aorta : 8
sampai 19 persen (16 persen pasien mengalami infeksi pada berbagai tempat).
Pada pecandu obat terlarang intravena, katup normal yang terinfeksi adalah 75 sampai 93 persen pasien. Pasien sisanya
mengalami kelainan katup aorta atau kelainan katup mitral sebelumnya yang
terutama disebabkan oleh penyakit jantung rematik, penyakit jantung bawaan,
atau pernah mengalami endokarditis infektif sebelumnya. Penggunaan obat
terlarang intravena adalah faktor risiko untuk kambuhnya endokarditis katup.
Patofisiologi
Pada prinsipnya semua kasus EI
berkembang melalui proses yang kurang lebih sama, yaitu :
- Bakteremia (nosokomial atau spontan)
yang menghantarkan mikroorganisme menuju permukaan katup jantung
- Perlekatan mikroorganisme tersebut
- Invasi yang pada akhirnya terjadi
pada valvular leaflets
Interaksi
antara host dengan mikroorganisme yang menimbulkan EI
mencakup endotel pembuluh darah, mekanisme hemostatik, system immune
host, kelainan anatomis pada jantung, sifat mikroorganisme, produksi toksin dan enzim oleh
mikroorganisme, dan peristiwa perifer
yang memulai terjadinya bakteremia. Setiap komponen pada interaksi tersebut kompleks,
diketahui terdapat banyak faktor dan belum diketahui sepenuhnya. Interaksi yang kompleks tersebut menghasilkan
rangkaian patogenesis dari organisme
mencapai permukaan katup, menetap di katup,
berproliferasi hingga menimbulkan kerusakan setempat, dan akhirnya menyebar dalam tubuh secara
hematogen. Studi in vitro dan in
vivo secara detail maupun dengan
manipulasi genetik telah dilakukan untuk
mengetahui patogenesis EI yang disebabkan oleh Streptokokkus viridians dan Stafilokokkus aureus. Jarangnya terjadi endokarditis walaupun
terjadi bakteremia menunjukkan bahwa
endotel jantung yang intak (utuh)
relatif tahan terhadap infeksi.
Kerusakan endotel jantung menghasilkan deposit trombosit dan fibrin dimana deposit tersebut peka terhadap
kolonisasi bakteri. Dibanding endotel jantung yang intak. Diduga deposit trombosit dan fibrin terjadi
secara spontan pada penderita penyakit katup jantung dan disebut endokarditis trombotik
nonbacterial (ETNB) kemudian menjadi
tempat perlekatan mikroorganisme ketika
terjadi bakteremia untuk memulai terjadinya Endokarditis infektif.
Proses
Terjadinya Endokarditis Trombotik Nonbakterial
Terdapat dua
mekanisme utama pada proses terjadinya ETNB
yaitu kerusakan endotel dan hiperkoagulasi. ETNB ditemukan pada 1,3 persen pasien pada
otopsi dan frekuensinya meningkat seiring pertambahan usia dan pada pasien
kanker, koagulasi intravaskuler
disseminate, penyakit katup jantung, dan kateterisasi jantung. ETNB ditemukan
pada garis persentuhan katup ketika menutup
pada permukaan katup mitral dan katup trikuspidalis yang menghadap ke atrium dan pada permukaan katup aorta dan katup
pulmonal yang menghadap ke ventrikel, dimana lokasi tersebut adalah lokasi
infeksi yang ditemukan pada pasien endokarditis infektif.
Terdapat tiga kondisi hemodinamika
yang dapat menimbulkan jejas / kerusakan endotel jantung yaitu (1) kecepatan
darah yang sangat tinggi yang mengenai permukaan endotel jantung, (2) aliran darah dari rongga jantung yang
bertekanan tinggi ke rongga jantung yang bertekanan rendah, dan (3) aliran
darah yang cepat yang melalui orifis katup yang sempit. Dimana bakteri paling banyak terdeposit pada
area yang bertekanan rendah dan sangat
sedikit pada area setelah orifis karena tersapu oleh aliran darah yang sangat
tinggi. Di lokasi itulah terbentuk ETNB akibat kondisi hemodinamika. Efek Venturi
juga dikaitkan dengan perkembangan dan lokasi ETNB, efek ini menjelaskan
mengapa bakteri dan trombus fibrin-platelet dideposit pada sisi dengan tekanan
rendah yang terletak dekat dari penyempitan atau stenosis. Pembentukan ETNB
yang akan ditempati oleh bakteri dapat membantu menjelaskan penyebaran vegetasi / deposit yang
terinfeksi.
Perubahan
Endokarditis Trombotik Nonbakterial Menjadi Endokarditis Infektif
Bakteremia adalah kejadian pertama
yang kemudian mengubah ETNB menjadi EI. Frekuensi dan beratnya bakteremia akibat aktifitas sehari-hari dan prosedur tindakan di rumah sakit
tampaknya berkaitan dengan permukaan mukosa tertentu dan kulit, kepadatan koloni
bakteri, penyakit pada mukosa, dan luas jejas setempat. Angka kejadian bakteremia paling tinggi pada
trauma mukosa rongga mulut khususnya trauma pada gingival/gusi, dan menurun secara progresif pada trauma
mukosa traktus urogenital dan traktus gastrointestinal oleh tindakan medis.
Penyakit pada mukosa khususnya penyakit infeksi sangat beresiko menimbulkan
bakteremia.
Agar mikroorganisme dalam sirkulasi
mencapai ETNB, mikroorganisme tersebut harus resisten terhadap efek bakterisidal komplemen dalam serum. `
Perlekatan mikroorganisme pasa
ETNB atau pada endotel katup yang tampak
intak merupakan kejadian penting
pertamaj pada terjadinya EI. Interaksi antara molekul permukaan bakteri dengan matriks ekstrasel endotel katup memperantarai perlekatan bakteri pada endotel
katup atau ETNB. Secara keseluruhan molekul-molekul bakteri itu disebut microbial surface component recognizing
adhesive matrix molecules (MSCRAMM).
Streptokokuus yang menghasilkan polisakarida permukaan yang disebut glucans atau dextran lebih sering menimbulkna endokarditis
daripadastrain yang tidak memproduksi dextran.
Dextran pada permukaan membrane streptokokkus telah dibuktikan
memperantarai perlekatannya pada deposit fibrin dan katup yang cedera dan
memfasilitasi terjadinya endokarditis pada penelitian eksperimental. Akan
tetapi tidak semua penyebab EI menghasilkan dextran sehingga sehingga terdapat mekanisme perlekatan
lainnya. Sebagai contoh, Fim A protein yang dihasilkan oleh Streptokokkus
parasanguis termasuk kelompok adhesin
mukosa mulut memfasilitasi
perlekatannya pada fibrin dan terjadinya endokarditis pada eksperimen.
Fibronektin, sebagai salah satu
faktor penting pada patogenesis EI telah ditemukan pada lesi katup jantung, dan
diproduksi oleh sel-sel endotel, trombosit dan fibroblast ketika terjadi
kerusakan pada pembuluh darah. Bentuknya yang larut berikatan dengan kolagen di
bawah endotel. Reseptor untuk fibronektin, MSCRAMM (microbial surface components recognizing adhesive matrix molecules), terdapat pada permukaan membrane
stafilokokkus aureus. Streptokokkus
viridians, streptokokkus grupa A, grup C
dan grup G, enterokokkus, Stafilokokkus pneumoniae, dan kandida albikans.
Fibronektin mempunyai banyak domnain ikatan
sehingga dapat mengikat secara bersamaan , fibrin, kolagen, sel-sel, dan
mikroorganisme dan memfasilitasi
perlekatan bakteri pada katup yang cedera atau pada ETNB. Protein A dan protein B yang mengikat fibronektin
pada Stafilokokkus aureus sangat penting pada proses terjadinya endokarditis
pada eksperimen. Clumping factor (atau protein membrane yang mengikat fibrinogen) pada
S. aureus juga memperantarai perlekatan
mikroorganisme tersebut pada thrombus trombosit-fibrin dan pada katup aorta yang
ditemukan pada endokarditis eksperimental.
Glikokaliks pada permukaan membrane S. epidermidis tidak berperan
sebagai adhesin akan tetapi dapat meningkatkan virulensi organisme dengan cara
meningkatkan kemampuan organism untuk bertahan terhadap system immune host.
Mekanisme organisme virulen
membentuk koloni dan menginfeksi endotel katup yang intak masih kurang jelas.
Pada orang usia lanjut, sklerosis katup
degeneratif menimbulkan radang setempat
yang pada akhirnya akan memicu pengikatan fibronektin pada sel
endotel dan pada molekul matriks
ekstrasel lainnya.
Bahan-bahan partikel yang
disuntikkan intravena oleh para pemakai obat terlarang akan memicu kejadian
yang serupa pada endotel jantung.
Perubahan endotel tersebut akan memicu perlekatan S.aureus melalui MSCRAMM (microbial surface components recognizing adhesive matrix molecules)
pada katup yang tampak normal.
Pengikatan protein yang mengikat fibronektin pada S. aureus dibutuhkan
untuk invasi sel-sel endotel yang intak. Multiplikasi organism intrasel akan
menimbulkan kematian sel yang ditempatinya. Yang akhirnya merusak membrane
endotel dan memulai pembentukan deposit
trombosit-fibrin dan tempat perlekatan bakteri semakin meluas.
Setelah melekat pada ETNB atau
endotel, syaratnya bakteri harus bertahan dan bermultiplikasi untuk menimbulkan
EI. Resistensi Stretokokkus viridians dan S.aureus terhadap protein antimikroba
pada trombosit meningkatkan kemampuan
bakteri untuk menimbulkan endokarditis. Persistensi dan multiplikasi
menghasilkan proses dinamis yang kompleks yaitu vegetasi yang terinfeksi
ukurannya bertambah oleh agregasi trombosit dan fibrin, mikroorganisme
bermultiplikasi dan terlepas ke dalam darah dan akhirnya fragmen vegetasi
menjadi emboli. Protein membrane
stafilokokkus dan streptokokkus
berikatan dengan trombosit dan memicu agregasi dan pertumbuhan vegetasi.
Organisme yang mengikat dan mengagregasi trombosit lebih virulen pada
eksperimen. Selain itu streptokokkus dan stafilokokkus meningkatkan proses
pembekuan darah setempat dengan cara merangsang monosit untuk melekat pada
fibrin kemudian bereaksi dengan faktor jaringan (yaitu tromboplastin jaringan
yang terikat pada factor VII yang aktif
untuk memulai pembekuan darah). Di samping itu, S aureus merangsang
produksi faktor jaringan oleh sel-sel endotel yang kemudian akan memfasilitasi
terjadinya endokarditis pada katup yang normal.
Siklus berulang-ulang mulai dari perlekatan sampai multiplikasi dan
pembentukan deposit trombosit-fibrin menimbulkan klinis endokarditis infektif.
Terlepas dari gejala-gejala infeksi
yang diperantarai oleh sitokin, manifestasi klinis EI disebabkan oleh (1) efek
kerusakan setempat yang ditimbulkan oleh infeksi dalam jantung, (2) pembentukan
emboli oleh serpihan atau fragmen vegetasi yang mengandung kuman yang berpindah
ke tempat lainnya yang jauh dari jantung (3) adanya sumber infeksi hematogen di
tempat yang jauh selama bakteremia, (4) respon antibody terhadap mikroorganisme
yang menginfeksi dengan akibat kerusakan jaringan karena deposit kompleks
immune atau interaksi antibody-komplemen dengan antigen yang terdeposit pada
jaringan.
Akibat dari EI dalam jantung mulai dari efek ringan
berupa vegetasi yang terinfeksi tanpa kerusakan jaringan hingga efek berat jika
infeksi menimbulkan kerusakan setempat
atau meluas di luar daun katup jantung.
Distorsi atau perforasi daun katup, rupture korda tendinae, dan
perforasi atau fistel antara pembuluh darah besar dengan rongga jantung atau
antar rongga jantung itu sendiri akibat infeksi yang menimbulkan lubang dapat
mengakibatkan gagal jantung kongestif (CHF) yang progresif. Infeksi, khususnya
yang mengenai katup aorta atau katup prostetik
dapat meluas ke jaringan disekitar katup
dan menimbulkan abses dan demam persisten karena infeksi tidak
responsive terhadap antibiotic, terputusnya system konduksi jantung yang
menghasilkan gambaran EKG abnormal, dan aritmia atau perikarditis purulen. Vegetasi yang besar khususnya pada katup
mitral dapat mengakibatkan stenosis katup fungsional dan gangguan hemodinamika. Secara umum, komplikasi dalam jantung yang
mengenai katup aorta berkembang lebih cepat daripada jika mengenai katup
mitral. Akan tetapi progresinya sangat bervariasi pada setiap individu.
Pembentukan emboli dari fragmen
vegetasi yang menghasilkan gejala-gejala infeksi atau infark dijumpai pada 11-43 % pasien. Akan tetapi bukti-bukti emboli pada otopsi
lebih sering yaitu 45-55 %. Emboli paruyang biasanya mengandung kuman ditemukan pada 66-75% pemakai obat terlarang intravena yang menderita EI katup trikuspidalis. Bakteremia yang persisten (menetap) pada
EI dengan atau tanpa emboli yang
mengandung kuman dapat mengakibatkan
infeksi di oragan atau jaringann lainnya.
Infeksi tersebut menimbulkan abses berukuran kecil sampai ambses besar
dan bermanifestasi sebagai tanda dan gejala lokal atau sebagai demama persisten selama
pengobatan. EI yang disebabkan oleh
mikroorganisme virulen khususnya S.
aureus atau streptokokkus
betahemolitikus sering menimbulkan
komplikasi infeksi di tempat yang jauh daripada EI yang disebabkan oleh bakteri
yang tidak virulen misalnya Streptokokkus
viridians. Abses yang trebentuk di tempat yang jauh biasanya ukurannya
kecil Infeksi di tempat yang jauh
penting diperhatikan jika terapi yang diperlukan lebih dari sekedar antibiotik
yang diindikasikan untuk EI atau atau
apabila infeksi tersebut menjadi fokus lokasi yang menimbulkan relaps.
Endokarditis
Rematik
Terjadinya endokarditis reumatik disebabkan langsung
oleh demam reumatik suatu penyakit sistemik yang disebabkan oleh infeksi
streptococcus group A. Demam reumatik mempengaruhi persendian menyebabkan poli
artritis. Kerusakan jantung dan lesi sendi bukan akibat infeksi atau secara
langsung dirusak oleh organisme tersebut.
Kerusakan jantung dan lesi sendi bukan akibat infeksi,
artinya jaringan tersebut tidak mengalami infeksi atau secara langsung dirusak
oleh organisme tersebut, namun hal ini merupakan fenomena sensivitas atau
reaksi, yang terjadi sebagai respons terhadap Streptokokus hemolitikus. Leukosit darah akan tertimbun pada jaringan yang terkena
dan membran nodul, yang kemudian akan diganti dengan jaringan
parut. Miokardium tentu saja terlibat dalam proses inflamasi ini; artinya,
berkembanglah miokarditis rematik yang sementara melemahkan tenaga kontraksi
jantung. Demikian pula pericardium juga terlibat; artinya, juga terjadi
perikarditis rematik selama perjalanan akut penyakit. komplikasi miokardial dan
pericardial tersebut biasanya tanpa meninggalkan gejala sisa yang serius. Namun
sebaliknya endokarditis rematik mengakibatkan efek samping kecacatan permanen.
Endokarditis rematik secara anatomis dimanifestasikan
dengan adanya tumbuhan kecil yang transparan, yang menyerupai manik dengan
ukuran sebesar kepala jarum pentul, tersusun dalam deretan sepanjang tepi bilah
katup. Manik-manik kecil tersebut tampak tidak berbahaya
dan dapat menghilang tanpa merusak bilah katup, namun yang lebih sering mereka
dapat menimbulkan efek serius. Mereka menjadi awal terjadinya suatu proses yang
secara bertahap menebalkan bilah-bilah katup, menyebabkanya menjadi memendek
dan menebal dibanding yang normal, sehingga tak dapat menutup dengan sempurna.
Terjadilah kebocoran, suatu keadaan yang disebut regurtasi katup. Tempat yang
paling sering mengalami regurtasi katup adalah katup mitral.
Pada pasien lain, tepi bilah katup yang meradang
menjadi lengket satu sama lain, mengakibatkan stenosis katup, yaitu penyempitan
lumen katup. Sebagian kecil pasien dengan demam reumatik menjadi sakit berat
dengan gagal jantung yang berat, disritmia serius, dan pneumonia rematik.
Pasien ini harus dirawat diruang perawatan intensif.
Kebanyakan pasien sembuh dengan segera dan biasanya
sempurna. Namun, meskipun pasien telah bebas dari gejala, masih ada beberapa
efek residual permanen yang tetap tinggal yang sering menimbulkan deformitas
katup progresif. Beratnya kerusakan jantung, atau bahkan keberadaannya, mungkin
tidak tampak pada pemerikasaan fisik selama fase akut selama ini. Namun,
kemudian bising jantung yang khas untuk stenosis katup, regurgitasi atau
keduanya dapat terdengar pada auskultasi dan pada beberapa pasien, bahkan dapat
terdeteksi adanya thriil pada saat palpasi. Miokardium biasanya dapat
mengkompensasi defek katup tersebut dengan baik sampai beb erapa waktu
tertentu. Selama miokardium masih bias mengkompensasi, pasien masih dalam
keadaan sehat. Namun cepat atau lambat, miokardium gagal jantung akan muncul,
apabila terjadi dekompensasi.
- Efek destruktif local, akibat infeksi intrakardiak
- Embolisasi yang berasal dari organ lain
- Bakteremia
- Reaksi antibody pada orbanisme penyebab infeksi
Port d’entrée (tempat masuk/ tinggalnya kuman) antara
lain di tonsil, gigi, farinks, intestinum, traktus urogenetalia. Melalui peredaran darah maka
bakteri melekat pada katub jantung yang rusak maupun endokardium, kemudian
terbentuk suatu
thrombus + fibrin dan didalamnya bakteri-bakteri tersebut berkumpul dan
berkembang biak. Begitu pula dalam tindakan-tindakan bedah urologis
(sistokopi), partus/ abortus, cabut gigi dapat menyebabkan endokarditis.
Manifestasi Klinis
Interval antara bakteremia dengan
mula timbulnya gejala-gejala EI
diperkirakan kurang dari 2 minggu pada lebih dari 80 persen pasien endokarditis katup. Yang menarik, pada beberapa
pasien yang mengalami infeksi katup prostetik perioperatif dan intraoperatif,
masa inkubasinya lebih lama yaitu 2
sampai 5 bulan atau lebih.
Endokarditis infektif yang akut
lebih sering terjadi pada jantung normal. Penyakit timbul mendadak. Tanda-tanda
infeksi lebih menonjol, seperti panas yang tinggi dan menggigil, jarang namun ditemukan
jari tabuh dan Janeway lesions
(bercak kemerahan pada telapak tangan dan kaki). Terdapat tanda-tanda pada
mata berupa petekie konjungtiva, perdarahan retina, kebutaan, tanda-tanda endoftalmitis, dan panoftalmitis. Emboli biasanya lebih sering
terjadi dan umumnya menyangkut pada arteri yang lebih besar sehingga
menimbulkan infark atau abses
paru dan sebagainya. Bising jantung baru atau perubahan bising jantung dapat
terjadi.
Endokarditis infektif subakut hampir
selalu mengenai jantung abnormal. Gejala timbul lebih kurang 2 minggu sesudah
masa inkubasi. Keluhan umum yang sering dirasa adalah demam tidak terlalu
tinggi, letih, lesu, banyak keringat malam, nafsu makan berkurang, berat badan
menurun, sakit kepala, dan sakit sendi. Bila terjadi emboli akan timbul keluhan
seperti paralisis, sakit dada, hematuria, sakit perut, buta mendadak, sakit pada jari tangan, dan sakit pada
kulit.
Demam dapat berlangsung
terus-menerus, remiten, intermiten, atau sama sekali tidak teratur, dengan
puncak panas 38-40oC dan terjadi pada sore atau malam hari. Sering
disertai menggigil pada suhu badan yang tinggi, diikuti keringat banyak.
Anemia, pembesaran hati, dan limpa dapat terjadi. Gejala emboli dan vaskular
dapat terjadi berupa petekie pada mukosa tenggorokan, mata, dan juga pada semua bagian kulit, terutama di
dada. Bagian tengah petekie biasanya lebih pucat dan dapat terjadi pada retina yang disebut Roth’s spot. Emboli yang
timbul di bawah kuku jari tangan dan kaki berbentuk linier berupa bercak
kemerahan, disebut splinter
hemorrhage. Lesi yang lebih spesifik (ada yang mengatakan
patognomonik) adalah Osler’s nodes,
yaitu penonjolan kulit berwarna kebiruan/kemerahan, yang memiliki sifat
khas berupa rasa nyeri, terdapat pada kulit tangan (tenar dan hipotenar) dan
kaki, terutama pada ujung jari. Emboli besar dapat menimbulkan gangguan saraf
sentral dan psikiatri, infark miokard akut, aneurisma mikotik, sesak napas, glomerulonefritis, gagal ginjal, serta
infark ginjal. Tanda-tanda kelainan jantung penting untuk menentukan adanya
kelainan katup dan kelainan bawaan. Tanda lain yang dapat ditemukan adalah
sesak napas, takikardi, aritmia, sianosis, atau jari tabuh. Pada stadium akhir
terjadi gagal jantung dan lebih
sering terjadi pada insufisiensi mitral
dan aorta.
 |
| Penampakan Oslers Node pada pasien pria usia 43 tahun (Dikutip dari wikipedia.org) |
Satu atau lebih tanda klasik dari EI yang ditemukan pada sebanyak 50% pasien antara lain :
- Petechiae: temuan yang umum tapi tidak spesifik
- Subungual (splinter) hemorrhages: lesi linear berwarna merah gelap pada dasar kuku
- Osler nodes: nodul subkutan empuk yang biasanya ditemukan di distal bantalan jari
- Janeway lesions: maculae keras pada telapak tangan dan kaki
- Roth spots: Perdarahan retina dengan inti bening yang kecil; jarang ditemukan
Tanda kelainan neurologis, yang dapat terjadi pada 40% pasien, antara lain :
- Stroke embolik dengan defisit fokal neurologis (temuan neurologis yang paling umum)
- Perdarahan intracerebral
- Multiple microabscesses
Other signs of IE include the following:
- Splenomegaly
- Leher kaku
- Delirium
- Paralysis, hemiparesis, aphasia
- Conjunctival hemorrhage
- Pallor
- Gallops
- Rales
- Cardiac arrhythmia
- Pericardial rub
- Pleural friction rub
Endokarditis katup bawaan asli subakut
Gejala dari endocarditis subakut pada katup bawaan asli awal biasanya tersamar dan nonspesifik, antara lain adalah :
- Demam rendah : absen pada 3-15% pasien
- Anorexia
- Berat badan berkurang
- Sindroma menyerupai influenza
- Sindroma menyerupai polymyalgia
- Nyeri pleura
- Sindroma mirip dengan demam rematik, seperti demam, sensoris yang tumpul (seperti pada typhoid), nyeri kepala
- Gejala abdominal, seperti nyeri pada quadrant kanan atas, muntal, postprandial distress, gejala menyerupai radang usus buntu

Komplikasi
Pada semua organ dapat terjadi komplikasi bila terjadi emboli yang infektif. Komplikasi gagal jantung yang paling sering ditemukan adalah gagal jantung sedang sampai berat, dan pada endokarditis akut sering disebabkan oleh ruptur aorta dan otot papilaris. Diantara berbagai manifestasi klinik dari endokarditis komplikasi neurologi merupakan hal yang penting karena sering terjadi, merupakan komplikasi neurologik. Dapat melalui 3 cara:
Pada semua organ dapat terjadi komplikasi bila terjadi emboli yang infektif. Komplikasi gagal jantung yang paling sering ditemukan adalah gagal jantung sedang sampai berat, dan pada endokarditis akut sering disebabkan oleh ruptur aorta dan otot papilaris. Diantara berbagai manifestasi klinik dari endokarditis komplikasi neurologi merupakan hal yang penting karena sering terjadi, merupakan komplikasi neurologik. Dapat melalui 3 cara:
- penyumbatan dari pembuluh darah oleh emboli yang berasal dari vegetasi endokardial
- infeksi meningen, jaringan otak, dinding pembuluh darah karena septik emboli atau bakterimia
- reaksi immunologis
Melalui
mekanisme tersebut dapat menyebabkan:
- infark atau infark berdarah
- pendarahan intra serebral, SAB, perdarahan subdural
- proses desak ruang, seperti abses atau mycotic aneurysma
- perubahan fungsi otak karena berbagai faktor
Bila
terjadi emboli akan akan mengakibatkan:
- Gejala neurologik fokal bila mengenal hanya satu pembuluh darah
- lebih dari satu pembuluh darah tergantung dari istemianya apakah dapat membaik sebelum terjadi kerusakan yang permanen maka gejalanya mirip TIA, atau bila berlanjut menyebabkan kerisakan jaringan otak dan terjadi proses supurasi.
Hal
tersebut mengakibatkan:
- sepsis atau septic meningitis
- abses, mikro absces otak
- meningoencephalitis
Bila
dinding arteri atau vasa vaserum terkena maka akan terjadi aneurisma, yang akan
mengakibatkan pecahnya pembuluh darah yang bersangkutan. Berbagai factor yang
dapat menimbulkan kelainan neurologis yaitu: Hipoksia, ganguan metabolisme,
pengaruh obat-obatan, pengaruh toksis dari infeksi systemic, reaksi imunitas
terhadap pembuluh darah, proliferatif endarteritis.
Komplikasi
dapat terjadi disemua organ bila terjadi emboli infektif
1.
Gagal
jantung
Komplikasi yang paling sering ditemukan adalah gagal jantung
sedang sampai berat dan kematian terjadi 85% dari 95 kasus
2.
Emboli
Emboli terjadi pada 13-35% endokarditis
infektif subakut dan 50-60% pada penderita endokarditis akut. Emboli arteri
sering terjadi pada otak, paru, arteri koronaria, limpa, ginjal, ekstrimitas,
usus, mata dan lain-lain.
3.
Aneurisma
nekrotik
Terjadi pada 3-5% endokarditis infektif dan
akan mengalami perdarahan
4.
Gangguan
neurologik
Ditemukan pada 40-50% endokarditis
infektif. Ganguan bisa berupa, gangguan kesadaran, gangguan jiwa (psikotik)
meningo ensepalitis steril. Kelainan pada pembuluh darah otak 80% disebabkan
infark dan 20% karena perdarahan otak
Diagnosis
Secara
umum, kriteria Duke seharusnya terpenuhi untuk menegakkan diagnosis
endokarditis. Pemeriksaan darah seperti C-Reactive
Protein (CRP) dan procalcitonin ditemukan tidak terlalu membantu untuk
menegakkan atau menyingkirkan diagnosis.
Dikarenakan
kriteria Duke sangat bergantung pada pemeriksaan ekokardiografi, penelitian kriteria
ini menyebutkan kapan seharusnya dilakukan ekokardiogram dengan menggunakan
tanda dan gejala untuk memprediksi endokarditis tersamar diantara pasien
penyalahgunaan obat intravena maupun pasien endokarditis jenis lainnya.
Sayangnya, penelitian ini berumur lebih dari 20 tahun dan mungkin terjadi
perubahan pada epidemiologi endokarditis
dan bakteri seperti stafilokokki
sehingga membuat perkiraan semula kurang tepat lagi.
Kriteria Duke yang Dimodifikasi
Pertama kali dikemukakan pada tahun 1994 oleh Duke Endocarditis Service dan direvisi
pada tahun 2000, kriteria Duke merupakan kumpulan kriteria mayor dan minor yang
digunakan untuk menegakkan diagnosis endokarditis infektif. Menurut kriteria
Duke, diagnosis EI dapat berupa diagnosis pasti, memungkinkan, atau pasti
bukan. Diagnosis endokarditis infektif
dikatakan pasti jika kriteria patologis atau klinis berikut terpenuhi :
- Salah satu dari kriteria patologis ini ditemukan :
- Histologi atau kultur vegetasi kardiak, vegetasi yang
terembolisasi, ditemukan mikroorganisme dari abses intrakardiak
- Endokarditis aktif
- Salah satu kombinasi kriteria klinis ini ditemukan :
- 2 kriteria klinis mayor
- 1 kriteria mayor dan 3 kriteria minor
- 5 kriteria minor
Diagnosis endokarditis infektif dikatakan
memungkinkan jika salah satu kombinasi kriteria klinis berikut ditemukan :
- 1 kriteria mayor dan 1 kriteria minor
- 3 kriteria minor terpenuhi
Kriteria Mayor
- Kultur darah positif dengan mikroorganisme khas endokarditis
infektif, didefinisikan sebagai berikut :
- Mikroorganisme khas sesuai dengan EI yang diperoleh dari 2 kultur
darah yang terpisah, antara lain :
- Viridans-group streptococci, atau
- Streptococcus bovis including nutritional variant strains, atau
- Grup HACEK
atau
- Staphylococcus aureus, atau
- Enterococci yang didapat dari
lingkungan, apabila
tidak ada fokus primer
- Mikroorganisme sesuai dengan endokarditis infektif yang diperoleh
dari kultur darah yang dilakukan
berturut-turut, didefinisikan sebagai berikut :
- Dua kultur darah positif yang dilakukan
terpisah > 12 jam, atau
- Semua dari 3 atau mayoritas 4 kultur darah
terpisah (dengan yang pertama dan terakhir terpisah 1 jam )
- Coxiella burnetii ditemukan pada setidaknya satu kultur darah
positif atau titer antibodi IgG fase 1 demam Q antigen > 1:800. (ini
sebelumnya adalah kriteria minor)
- Bukti adanya keterlibatan endokardial yang ditunjukkan dengan
ekokardiogram positif didefinisikan sebagai berikut :
- Massa intrakardiak yang berosilasi pada katup atau struktur
pendukung, pada jalur regurgitant
jet, atau adanya materi tertanam yang tidak bisa dijelaskan secara
anatomis, atau
- Abses, atau
- Pembukaan luka operasi sebagian (dehiscence / eviscerasi) dari
katup buatan atau regurgitasi katup yang baru (pemburukan atau perubahan
murmur yang ada sebelumnya tidak cukup)
Kriteria Minor
- Faktor predisposisi : lesi kardiak yang diketahui, penyalahgunaan
obat suntik intravena
- Demam > 38 °C
- Bukti embolisme : emboli arterial, infark pulmonal, Janeway lessions, perdarahan
konjungtival
- Masalah imunologis : glomerulonefritis, Osler's nodes, Roth's
spots, faktor Rheumatoid
- Bukti
mikrobiologis : kultur darah positif (yang tidak memenuhi kriteria mayor)
atau bukti serologis akan adanya infeksi mikroorganisme sesuai dengan
EI tapi tanpa kriteria mayor yang
memuaskan
Ekokardiografi
Ekokardiogram
transtorasik atau transthoracic echocardiogram (TTE) memiliki sensivitas dan
spesifitas sekitar 65% dan 95% jika sang kardiografer memiliki kepercayaan akan
adanya bukti endokarditis yang ‘memungkinkan’ atau ‘hampir pasti’ Dimasukkannya ekokardiografi dalam kriteria adalah
karena ekokardiografi dua dimensi dengan color Doppler sangat sensitif khususnya jika multiplanar TEE (transesophageal echocardiogram) dan TTE digabungkan, dan
frekuensi positif palsu sangat rendah apabila operator ekokardiografi yng
berpengalaman menggunakan definisi khusus untuk vegetasi. Walaupun sensitivitas TEE dalam mendeteksi
vegetasi pada pasien yang disuspect EI adalah 85 sampai 95 persen ( lebih
tinggi jika dilakukan pemeriksaan pada follow-up), hasil yang negative tidak
menyingkirkan diagnosis atau pengobatan apabila kecurigaan EI cukup tinggi. Kemungkinan hasil negatif
palsu dapat berkurang menjadi 5 sampai 10 persen apabila TEE diulangi,
khususnya apabila pemeriksaannya biplanar atau multiplanar. Jadi akan membantu
menyingkirkan diagnosis ketika kecurigaan EI rendah. Selain itu, karena ekokardiografi tidak dapat
membedakan antara vegetasi yang sudah sembuh dengan massa valvular
(vegetasi) yang mengandung kuman, maka agak sulit membedakan vegetasi EI dengan
vegetasi yang ditemukan pada marasmus, keganasan, penyakit kolagen vaskuler,
atau sindrom antibody antifosfolipid. Ekokardiografi bermanfaat untuk
mengetahui kerusakan anatomi/morfologi yang ditimbulkan oleh infeksi. Ekokardiografi tidak perlu dilakukan pada
pasien dengan kultur darah positif atau pasien demam yang tidak diketahui
penyebabnya (fever of unknown origin / FUO) jika dugaan kemungkinan
EI rendah. Akan tetapi ekokardiografi sebaiknya dilakukan pada setiap pasien
yang klinisnya mengarah ke EI, khususnya pasien yang kultur darahnya
negative. Pada pasien endokarditis katup
digunakan TEE biplane (dua bidang) ata
multiplane (banyak bidang) yang
mempunyai color dan pulsed Doppler karena lebih baik daripada TTE. Dengan TEE
dapat terlihat vegetasi kecil dan resolusinya lebih baik daripada TTE. Jadi TEE bukan hanya sangat bermanfaat untuk
pasien yang disuspect EI tetapi juga merupakan pilihan pemeriksaan untuk
mengevaluasi katup pulmonal, pasien endokarditis katup prostetik, dan pasien yang
beresiko tinggi mengalami komplikasi dalam jantung atau pasien yang tetap
mengalami infeksi atau invasi infeksi padahal sudah diberikan antibiotic.
Keputusan untuk pemeriksaan ekokardiografi untuk
diagnosis endokarditis katup pada pasien yang bakteremia, anggaplah jika
pemeriksaan dengan TEE meningkat kemunginan diagnosisnya sebesar 15 persen
disbanding TTE, maka strategi untuk menekan biaya pemeriksaan yang efektif
adalah (1) apabila kemungkinan IE kurang dari 2 persen maka obati pasien
bakteremia tanpa perlu pemeriksaan ekokardiografi, (2) apabila kemungkinan IE
adalah 2-4 persen maka gunakan TTE dan ap-abila (3) kemungkinan EI 5 sampai 45
persen gunakan TEE. Apabila kemungkinan IE lebih dari 45 persen maka pengobatan
tanpa ekokardiografi cukup menghemat biaya akan tetapi seringkali tetap dilakukan
TEE untuk mengevaluasi komplikasi dan resiko lainnya. Data-data hasil
pemeriksaan TEE biasanya tidak mengubah rencana pengobatan dari data yang
diperoleh dari TTE sebelumnya apabila TTE berhasil mendeteksi endokarditis.
 |
| Vegetasi pada katup trikuspid yang terlihat pada ekokardiografi. Vegetasi ditandai oleh panah (Dikutip dari wikipedia.org) |
Menentukan
Mikroba Penyebab
Mikroba penyebab EI dapat ditemukan dari darah atau dari
vegetasi yang diambil melalui pembedahan, atau dari material emboli. Untuk
mengetahui ada tidaknya bakteremia tidak perlu mengambil kultur darah vena atau
darah arteri karena sudah nyata ada demam. Pada pasien yang belum pernah mendapatkan
pengobatan antibiotik sebelumnya sekitar 95 sampai 100 persen pasien hasil kultur darahnya positif dan satu dari dua biakan pertama adalah
positif pada 95 persen pasien. Terapi antibiotik sebelumnya adalah penyebab utama hasil kultur negative pada EI,
khususnya apabila organism penyebabnya sangat peka terhadap antibiotik tersebut.
Sekitar 35 persen pasien EI hasil kultur negative disebabkan karena
pasien sudah menjalani pengobatan antibiotik. Jika sudah mendapatkan terapi
antibiotic di bawah dosis terapeutik maka waktu yang dibutuhkan agar kultur
kembali menjadi positif berkaitan dengan
lamanya terapi tersebut dan kepekaan organisme yaitu sekitar beberapa hari sampai satu minggu atau lebih.
Melakukan
Kultur Darah
Dianjurkan mengambil tiga set darah vena dengan lokasi
pungsi yang berbeda dalam 24 jam untuk mengevaluasi paisen yang diduga
endokarditis. Setiap set terdiri dari
dua tabung yaitu satu tabung berisi medium aerob dan tabung kedua berisi
thyoglycollate broth (medium anaerob). Sekurang-kurangnya 10 ml darah
dimasukkan ke dalam setiap tabung.
Petugas laboratorium sebaiknya diberitahu bahwa
kemungkinan diagnosanya adalah endokarditis
dan bisa saja disebabkan oleh bakteri yang tidak biasa (misalnya spesie
legionella, spesies Bartonella, atau organisme HACEK). JIka pasien stabil secara klinis dan sudah mendapatkan
pengobatan antibiotic selama beberapa minggu sebelumnya maka jangan dulu diberikan antibiotic agar
dapat diperoleh kultur positif pada hari-hari berikutnya. Jika diduga
penyebabnya kemungkinan besar jamur maka
maka darah yang dikultur harus dilisis dengan sentrifugasi (metode
lisis-sentrifugasi). Petugas
laboratorium harus diberitahu agar menyimpan organisme hasil kultur sampai pengobatan endokarditis
selesai. Pemeriksaan serologi kadang
dilakukan untuk diagnosis endokarditis yang diduga disebabkan oleh spesies
Brucella, spesies Legionella, spesies
Bartonella, spesies Burnetii, atau spesies Chlamidya. Dengan teknik khusus,
misalnya teknik PCR organisme yang sulit diketahui
melalui biakan darah atau serology dapat ditemukan dalam darah atau vegetasi.
Bakteremia menetap adalah khas pada EI. Bakteremia
menetap adalah bakteremia yang berlangsung minimal selama 1 jam. Jadi harus
dibedakan dengan bakteremia sementara yang berlangsung kurang dari 1 jam.
Apabila beberapa hasil kultur darah
positif dalam 24 jam atau lebih ditambah bakteremia menetap maka sangat kuat
diagnosanya adalah EI. Jenis organisme penyebab juga dapat menguatkan diagnosis. Organisme penyebab dikelompokkan menjadi tiga
yaitu yang sering menimbulkan EI, yang
jarang menimbulkan EI, dan organisme netral yaitu jika ditemukan dalam darah
dapat menyebabkan EI atau bukan EI misalnya
enterokokkus dan S. aureus.
Pemeriksaan Laboratorium
Hasil pemeriksaan hematologi biasanya abnormal. Ditemukan anemia normositik normokromik, kadar zat besi dalam serum rendah, serum iron-binding capacity rendah, pada 70
sampai 90 persen pasien. Anemia memburuk jika penyakit semakin lama sehingga
pada EI akut bisa tidak dijumpai anemia.
Pada EI subakut, jumlah leukosit bisa normal akan tetapi pada EI subakut
dijumpai peningkatan segmen
granulosit dan neutrofilia. Trombositopenia jarang.
Laju endap darah (LED)
meningkat yaitu sekitar 55
mm/menit pada hampir semua pasien EI. LED tidak meningkat pada CHF,
gagalginjal, atau koagulasi intravaskuler disseminate. Masih ada
pemeriksaan lainnya tetapi tidak perlu dilakukan karena biyanya mahal dan tidak efektif dalam
mendiagnosis EI misalnya pemeriksaan immune dan tanda-tanda peradangan
yaitu kompleks immune dalam sirkulasi,
factor rheumatoid, immune globulin,
cryio-globulin dan pemeriksaan kadar C-reactive protein. Pemeriksaan kompleks immune dan komplemen dalam sirkulasi bisa bermanfaat untuk mengevaluasi azotemia
yang disebabkan oleh glomerulonefritis kompleks immune difus. Pada pemeriksaan laboratorium
terdapat leukositosis (neutrofilia), anemia
normositik normokrom, peningkatan laju endap darah (LED), imunoglobulin serum
meningkat, uji fraksi gamaglobulin positif, total hemolitik komplemen dan
komplemen C3 dalam serum menurun, serta kadar bilirubin darah yang
sedikit meningkat.
Hasil urinalisis biasanya abnormal walaupun fungsi ginjal
normal. Proteinuria dan hematuria
mikroskopik (hematuria samar) ditemukan
pada 50 persen pasien.
Pemeriksaan
Penunjang lainnya
Foto toraks dilakukan untuk mencari
tanda-tanda gagal jantung
kongestif sebagai komplikasi yang sering, adanya bercak infiltrat kecil
multipel pada penyalahguna narkotika intravena, dan kalsifikasi katup.
EKG (Elektocardiogram) diperlukan
untuk mencari infark tersembunyi yang disebabkan emboli atau vegetasi pada
arteri koronaria, dan gangguan hantaran yang dapat disebabkan endokarditis.
Penatalaksanaan
Pengobatan akan berhasil baik bila dimulai sedini mungkin, obat tepat (terutama sesuai dengan uji resistensi), dan waktu yang cukup.
Pengobatan
empiris untuk endokarditis akut adalah dengan nafsilin 2 g/4 jam, ampisilin 2
g/4 jam dan gentamisin 1,5 mg/kg BB/8 jam. Sedangkm untuk endokarditis subakut
cukup dengan ampisilin dan gentamisin.
Pada
orang dewasa atau anak-anak dengan endokarditis disertai kelainan jantung
renatik dan bawaan dapat diberi penisilin G 2,4-6 juta unit/hari dan diteruskan
selama 4 minggu. Penisilin diberi secara parenteral selama 2 minggu dan
selanjutnya secara parenteral atau oral (penisilin V). Dapat ditambahkan
streptomisin 0,5 mg tiap 12 jam selama 2 minggu.
Pada
orang tua atau wanita setelah tindakan obstetrik dan ginekologis dapat diberi
penisilin G 1,2-2,4 juta unit/hari parenteral ditambah gentamisin 3-5 mg/kg BB
yang dibagi dalam 2-3 dosis. Ampisilin dapat dipakai dengan dosis 6-12 g
sehari. Lama pengobatan 4-6 minggu.
Bila
kuman resisten terhadap penisilin, dapat dipakai sefalotin 1,5 g tiap 3 jam iv
atau nafsin 1,5 g tiap 4 jam, oksasilin 12 g/hari atau vankomisin tiap 6 jam
atau eritromisin 0,5 g tiap 8 jam.
Endokarditis
yang disebabkan oleh jamur biasanya fatal, diberikan amfoterisin B 0,5-1,2
mg/kg BB/hari iv dan flurositosin 150 mg/kg BB per oral
Pemberian antibiotik saja tidak cukup pada
infeksi katup buatan. Mungkin perlu dilakukan pembedahan jantung untuk
memperbaiki atau mengganti katub yang rusak dan membuang vegetasi. Risiko
mortalitas dan morbiditas tinggi pada tindakan bedah yang terlalu awal, tapi
bila pembedahan terlambat dilakukan, pasien dapat meninggal karena hemodinamik
yang buruk atau komplikasi berat. Indikasi bedah adalah gagal jantung yang
tidak dapat diatasi dengan obat-obatan, septikemia yang tidak berespons dengan
pengobatan antibiotik, emboli multipel, endokarditis relaps, endokarditis pada
katup buatan, perluasan infeksi intrakardiak, endokarditis pada lesi jantung
bawaan,dan endokarditis karena jamur.
Profilaksis
antibiotik diperlukan pada tindakan yang memungkinkan terjadinya bakteremia,
misalnya operasi atau pencabutan gigi, American Heart Association
merekomendasikan pemberian amoksisilin 3 g secara oral pada 1 jam sebelum
prosedur diikuti 1,5 g pada 6 jam setelah dosis inisial. Bila pasien alergi
terhadap penisilin, dapat diberikan 800 mg eritromisin etilsuksinat atau 1 g
eritromisin stearat 2 jam sebelum prosedur, atau 300 mg klindamisin oral 1 jam
sebelum prosedur, diikuti pemberian berikutnya 6 jam setelah dosis inisial.
Dosis tinggi antibiotik diberikan
secara intravena untuk memaksimalkan difusi molekul antibiotik kedalam vegetasi
dari darah yang mengisi ruang jantung . Hal ini diperlukan karena baik katup
jantung maupun vegetasi yang menempel padanya tidak diberikan suplay darah oleh
pembuluh darah. Antibiotik biasanya diteruskan selama dua sampai dengan enam
minggu tergantung pada karakteristik infeksi dan mikroorganisme penyebabnya.
Pada endokarditis akut, dikarenakan
terapi antibiotik inflamasi empirik fulminan dimulai segera setelah
darah diambil untuk kultur. Biasanya diberikan vancomycin dan ceftriaxone
infusi IV sampai identifikasi mikroba dan laporan suseptabilitas dengan
konsentrasi inhibitory yang minimal tersedia sehingga memungkinakan dilakukan
modifikasi terhadap terapi mikroba untuk mentargetkan mikroorganisme yang
spesifik. Perlu dicatat bahwa penggunaan rutin gentamicin untuk menangani
endokarditis sudah tidak terlalu dipilih lagi karena kurangnya bukti untuk
mendukung penggunaannya (kecuali infeksi oleh Enterococcus dan beberapa varian
Streptococci) dan angka kejadian
komplikasi yang tinggi.
Pada
endokarditis subakut, dimana hemodinamik pasien biasanya stabil, pengobatan
antibiotik dapat ditunda sampai mikroorganisme penyebab dapat diidentifikasi.
Mikroorganisme yang paling umum
bertanggungjawab menyebabkan endokarditis infektif adalah Staphylococcus
aureus, yang pada kebanyakan kasus kebal terhadap penicillin. Tingkat
resistensi yang tinggi terhadap oxacillin juga dapat dijumpai, dimana akhirnya
dibutuhkan pengobatan dengan vancomycin.
Streptococci grup viridans dan Streptococci bovis biasanya suseptabel (peka
/ rentan) terhadap penicillin sehingga dapat diberikan pengobatan penicillin
dan ceftriaxone, yang mana biasanya diberikan selama 2 minggu awal
pengobatannya bersamaaan dengan aminoglikosida.
Kelompok yang resisten akan
penicillin dari Streptococci grup viridans, variant Sreptococci seperti Granulicatella
sp., Gemella sp. Abiotrophia
defectiva, dan Enterococci baiasanya diberikan kombinasi
penicillin dan aminoglikosida untuk jangka waktu 4-6 minggu.
Pasien tertentu dapat diberikan
dengan jangka waktu yang lebih pendek (2 minggu) dengan benzyl penicillin IV
jika infeksi disebabkan oleh Streptococci grup viridans atau Streptococcus bovis selama beberapa
kondisi berikut terpenuhi :
- Endokarditis
pada katup asli (alami / bawaan ), bukan endokarditis pada katup prostetik
(buatan)
- Minimum
Inhibitory Concentration (MIC) ≤ 0.12 mg/l
- Komplikasi
seperti gagal jantung, aritmia, dan emboli pulmonal terjadi
- Tidak
adanya bukti akan komplikasi ekstrakardiak seperti tromboembolisme sepsis
- Tidak ada
vegetasi > 5 mm diameter defek konduksi
- Respon
klinik dan klirens yang cepat dari infeksi aliran darah
Endokarditis katup bawaan sisi kanan
oleh Staphylococcus aureus yang peka terhadap oxacillin dapat diberikan
pengobatan jangka pendek 2 minggu dengan antibiotik beta laktam seperti
nafcillin dengan atau tanpa aminoglikosida.
Fungal endocarditis atau
endokarditis yang disebabkan oleh fungi (jamur) jarang terjadi dan utamanya
terjadi setelah pembedahan katup prostetik dan pada individu dengan
penyalahgunaan obat intravena. Candida species dan Aspergillus
species adalah organisme yang paling sering dijumpai. Untuk saat ini, agen
antifungi yang tersedia tidak sukses dalam menangani EI fungal. Cara
penyembuhan yang terbukti berguna untuk endokarditis infektif fungi adalah
dengan pembedahan eksisi dari katup yang terinfeksi yang dikombinasi dengan
terapi amphotericin B.
Pembedahan debridement dari materi
terinfeksi dan penggantian katup dengan katup buatan mekanik atau bioprostetik
diperlukan pada situasi tertentu :
- Pasien dengan stenosis atau regurgitasi katup berat yang menyebabkan gagal jantung
- Bukti adanya kelainan hemodinamik berupa end diastolic ventrikel kiri yang meningkat atau tekanan atrium kiri meningkat atau hipertensi pulmonal yang sedang sampai dengan berat
- Adanya komplikasi intrakardiak seperti abses paravalvular, defek konduksi atau lesi destruktif penetratif
- Emboli sepsis yang selalu berulang walaupun telah diberikan pengobatan antibiotik yang sesuai
- Vegetasi berukuran besar (> 10 mm)
- Kultur darah yang selalu positif walaupun telah diberikan pengobatan antibiotik yang sesuai
- Pembukaan luka operasi katup buatan (dehiscence)
- Infeksi yang timbul kembali pada pasien dengan katup buatan
- Pembentukan abses
- Penutupan terlalu dini katup mitral
- Infeksi yang disebabkan oleh fungi atau kuman gram negatif yang resisten
Pencegahan
Tidak
semua individu dengan penyakit jantung membutuhkan antibiotik untuk mencegah
endokarditis infektif. Penyakit jantung dapat diklasifikasikan menjadi yang
berisiko tinggi, menengah, atau rendah dalam kemungkinan menimbulkan
endokarditis infektif. Kategori risiko tinggi membutuhkan profilaksis EI
sebelum menjalani prosedur endoskopi dan prosedur yang dilakukan pada saluran
kemih. Penyakit jantung yang masuk
kategori risiko tinggi dapat menimbulkan endokarditis infektif antara lain :
- Adanya
riwayat endokarditis sebelumnya
- Penyakit
jantung kongenital sianotik yang belum tertangani
- Penyakit
jantung kongenital yang sudah tertangani tetapi masih dalam jangka waktu 6
bulan pertama
- Katup
jantung buatan (prostetik)
- Penyakit
jantung kongenital yang baru tertangani sebagian
- Cardiac
transplant valvulopathy
Berikut
adalah antibiotik yang disarankan oleh the
American Heart Association sebagai antibiotik profilaksis:
- Amoxicillin per oral 1 jam sebelum prosedur
- Ampicillin intravena atau intramuskular 1 jam sebelum prosedur
- Pada pasien dengan alergi terhadap penicillins :
- Azithromycin atau clarithromycin per oral 1 jam sebelum prosedur
- Cephalexin per oral 1 jam sebelum prosedur
- Clindamycin per oral 1 jam sebelum prosedur
Di negara inggris (UK), panduan
pedoman klinis NICE (National Institute
for Health and Clinical Excellence) tidak
lagi menyarankan profilaksis dikarenakan tidak adanya bukti klinis bahwa hal
tersebut dapat mengurangi insidensi EI dan terdapat efek negatif (seperti
alergi dan peningkatan resistensi bakteri) dari antibiotik yang lebih berat
ketimbang manfaatnya.
Dalam sejarah antibiotik lebih umum
direkomendasikan untuk mencegah endokarditis infektif pada kelainan jantung
yang akan menjalani prosedur pada dokter gigi
(dikenal sebagai dental antibiotic
prophylaxis).
Prognosis
Pasien tanpa komplikasi yang berat dengan pemakaian antibiotik yang adekuat, prognosis umumnya baik. Prognosis buruk bila ditemukan mikroorganisme yang resisten terhadap antibiotik, payah jantung, pengobatan terlambat, bakteremia, infeksi terjadi setelah pemasangan, pasien geriatri tanpa disertai demam, dan keadaan umum yang buruk.
Pasien tanpa komplikasi yang berat dengan pemakaian antibiotik yang adekuat, prognosis umumnya baik. Prognosis buruk bila ditemukan mikroorganisme yang resisten terhadap antibiotik, payah jantung, pengobatan terlambat, bakteremia, infeksi terjadi setelah pemasangan, pasien geriatri tanpa disertai demam, dan keadaan umum yang buruk.
Prognosis
secara besar dipengaruhi oleh apakah komplikasi berkembang atau tidak. Jika
dibiarkan tidak ditangani, EI secara umum fatal. Deteksi dini dan
penatalaksanaan yang sesuai dari penyakit ini dapat menyelamatkan nyawa. Angka
kematian penyakit ini relatif stabil di 14,5%.
Angka
(rate) kesembuhan untuk EI yang ditangani secara tepat (baik dengan pengobatan
maupun terapi bedah) pada individu dengan katup asli (bawaan) adalah :
- Untuk
infeksi S viridans dan S
bovis , angkanya adalah 98%.
- Untuk
infeksi enterococci dan S aureus pada individu dengan
penyalahgunaan obat intravena, angkanya adalah 90%.
- Untuk infeksi
S aureus community-acquired pada individu yang tidak
menyalahgunakan obat terlarang intravena, angkanya adalah 60-70%.
- Untuk
infeksi organisme gram-negatif aerobik angkanya adalah 40-60%.
- Untuk
infeksi dengan organisme fungal angkanya adalah lebih rendah dari 50%.
Untuk
individu dengan katup buatan (prostetik), angka kesembuhan adalah sebagai
berikut :
- Angka
(Rate) lebih rendah 10-15% untuk tiap kategori diatas, baik untuk kasus
awal maupun yang terjadinya lambat.
- Pembedahan
lebih sering diperlukan
- Sekitar 60%
dari kasus endokarditis katup buatan awal karena CoNS dan 70% kasus
endokarditis katup buatan akhir karena CoNS dapat disembuhkan.
Laporan
anekdotal menunjukkan perbaikan kondisi infeksi sisi kanan yang disebabkan
infeksi S aureus pada individu yang
menyalahgunakan obat intravena hanya beberapa hari setelah pemberian antibiotik
oral.
Peran dari pembedahan katup dalam
mengurangi angka kematian diantara pasien EI semakin jelas. Studi terbesar
mengindikasikan bahwa pada kasus EI dengan komplikasi gagal jantung, pembedahan
katup mengurangi 1-year mortality rate
. Studi lebih baru mendokumentasikan pada pembedahan pada deteksi awal,
terutama dengan vegetasi ukuran besar, secara signifikan mengurangi risiko
kematian dari penyebab kejadian embolik.
Angka kematian pada katup bawaan
alami bervariasi antara 16-27%. Angka kematian pada pasien dengan katup
prostetik buatan lebih tinggi. Mortality rates in patients with PVE are higher.
Lebih dari 50% infeksi ini berlangsung kurang dari 2 bulan setelah pembedahan
penggantian katup. Fatalitas kasus endokarditis infektif pacemaker mencapai
34%.
Peningkatan
angka kematian diasosiasikan dengan peningkatan umur, infeksi yang melibatkan
katup aorta, berkembangnya gagal jantung kongestif, komplikasi sistem saraf
pusat, dan penyakit penyerta seperti diabetes mellitus.
Daftar Pustaka/Referensi
- Durack D, Lukes A, Bright D (1994). "New criteria for diagnosis of infective endocarditis: utilization of specific echocardiographic findings. Duke Endocarditis Service". Am J Med 96 (3): 200–9.
- Yu, CW; Juan, LI; Hsu, SC; Chen, CK; Wu, CW; Lee, CC; Wu, JY (June 2013). "Role of procalcitonin in the diagnosis of infective endocarditis: a meta-analysis.". The American journal of emergency medicine 31 (6): 935–41.
- Weisse A, Heller D, Schimenti R, Montgomery R, Kapila R (1993). "The febrile parenteral drug user: a prospective study in 121 patients". Am J Med 94 (3): 274–80.
- Samet J, Shevitz A, Fowle J, Singer D (1990). "Hospitalization decision in febrile intravenous drug users". Am J Med 89 (1): 53–7.
- Marantz P, Linzer M, Feiner C, Feinstein S, Kozin A, Friedland G (1987). "Inability to predict diagnosis in febrile intravenous drug abusers". Annals of Internal Medicine 106 (6): 823–8.
- Leibovici L, Cohen O, Wysenbeek A (1990). "Occult bacterial infection in adults with unexplained fever. Validation of a diagnostic index". Arch Intern Med 150 (6): 1270–2.
- Mellors J, Horwitz R, Harvey M, Horwitz S (1987). "A simple index to identify occult bacterial infection in adults with acute unexplained fever". Arch Intern Med 147 (4): 666–71.
- Shively B, Gurule F, Roldan C, Leggett J, Schiller N (1991). "Diagnostic value of transesophageal compared with transthoracic echocardiography in infective endocarditis". J Am Coll Cardiol 18 (2): 391–7.
- Erbel R, Rohmann S, Drexler M, et al. (1988). "Improved diagnostic value of echocardiography in patients with infective endocarditis by transoesophageal approach. A prospective study". Eur Heart J 9 (1): 43–53.
- Li, J. S.; Sexton, D. J.; Mick, N.; Nettles, R.; Fowler, V. G.; Ryan, T.; Bashore, T.; Corey, G. R. (2000). "Proposed Modifications to the Duke Criteria for the Diagnosis of Infective Endocarditis". Clinical Infectious Diseases 30 (4): 633–8.
- Kaech C, Elzi L, Sendi P, et al. (2006). "Course and outcome of Staphylococcus aureus bacteraemia: a retrospective analysis of 308 episodes in a Swiss tertiary-care centre". Clin Microbiol Infect 12 (4): 345–52.
- "Prophylaxis against infective endocarditis: Antimicrobial prophylaxis against infective endocarditis in adults and children undergoing interventional procedures". NICE Clinical Guidelines. National Institute for Health Care and Excellence (UK). March 2008. Retrieved 2015-04-30.
- Cosgrove SE, Vigliani GA, Campion M, et al. (2009). "Initial low‐dose gentamicin for Staphylococcus aureus bacteremia and endocarditis is nephrotoxic". Clin Infect Dis 48 (6): 713–21.
- Baddour, LM; et al. (14 June 2005). "Infective Endocarditis Diagnosis, Antimicrobial Therapy, and Management of Complications: A Statement for Healthcare Professionals From the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, and the Councils on Clinical Cardiology, Stroke, and Cardiovascular Surgery and Anesthesia, American Heart Association: Endorsed by the Infectious Diseases Society of America". Circulation 111 (23): e394–e434.
- Kalavakunta, Jagadeesh K.; Davenport, David S.; Tokala, Hemasri; King, Anthony; Khagny, Michael; Gupta, Vishal (2011-01-01). "Destructive Abiotrophia defectiva endocarditis". The Journal of Heart Valve Disease 20 (1): 111–112.
- Bonow, RO; et al. (23 September 2008). "2008 focused update incorporated into the ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to revise the 1998 guidelines for the management of patients with valvular heart disease). Endorsed by the Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons". Journal of American College of Cardiology 52 (13): e1–142.
- Dreier, J; et al. (2004). "Tropheryma whipplei Infection of an acellular porcine heart valve bioprosthesis in a patient who did not have intestinal Whipple's disease". Journal of Clinical Microbiology 42 (10): 4487–4493.
- Dzeing-Ella, A; Szwebel, T. A.; Loubinoux, J.; Coignard, S.; Bouvet, A.; Le Jeunne, C.; Aslangul, E. (December 2009). "Infective endocarditis due to Citrobacter koseri in an immunocompetent adult". Journal of Clinical Microbiology 47 (12): 4185–4186.
- Masliah-Planchon, J; et al. (June 2009). "Endocarditis due to Neisseria bacilliformis in a patient with a bicuspid aortic valve". Journal of Clinical Microbiology 47 (6): 1973–1975.
- Izumi, K; et al. (October 2009). "A rare case of infective endocarditis complicated by Trichosporon asahii fungemia treated by surgery". Annals of Thoracic and Cardiovascular Surgery 15 (5): 350–353.
- Hoen, Bruno; Duval, Xavier (11 April 2013). "Infective Endocarditis". New England Journal of Medicine 368 (15): 1425–1433.
- Wilson W, Taubert KA, Gewitz M, et al. (October 2007). "Prevention of infective endocarditis: guidelines from the American Heart Association". Circulation 116 (15): 1736–54.
- Zadik Y, Findler M, Livne S, et al. (December 2008). "Dentists' knowledge and implementation of the 2007 American Heart Association guidelines for prevention of infective endocarditis". Oral Surg Oral Med Oral Pathol Oral Radiol Endod 106 (6): e16–9.
- Elad S, Binenfeld-Alon E, Zadik Y, Aharoni M, Findler M. (March 2011). of acceptance of the 2007 American Heart Association Guidelines for the prevention of infective endocarditis: A pilot study "Survey of acceptance of the 2007 American Heart Association guidelines for the prevention of infective endocarditis: a pilot study" Quintessence Int 42 (3): 243–51.
- Heiro, M et al. “Infective Endocarditis in a Finnish Teaching Hospital: A Study on 326 Episodes Treated during 1980–2004.” Heart 92.10 (2006): 1457–1462. PMC. Web. 29 Apr. 2015.
- Mitchell RS, Kumar V, Robbins SL, Abbas AK, Fausto N (2007). Robbins Basic Pathology (8th ed.). Saunders/Elsevier. pp. 406–8.
- Morris AM (January 2006). "How best to deal with endocarditis". Curr Infect Dis Rep 8 (1): 14–22.
- Kasper DL, Brunwald E, Fauci AS, Hauser S, Longo DL, Jameson JL (May 2005). Harrison's Principles of Internal Medicine. McGraw-Hill. pp. 731–40.
- Otto M (2009), "Staphylococcus epidermidis — the 'accidental' pathogen", Nature Reviews Microbiology 7 (8): 555–567,
- Amal Mattu; Deepi Goyal; Barrett, Jeffrey W.; Joshua Broder; DeAngelis, Michael; Peter Deblieux; Gus M. Garmel; Richard Harrigan; David Karras; Anita L'Italien; David Manthey (2007). Emergency medicine: avoiding the pitfalls and improving the outcomes. Malden, Mass: Blackwell Pub./BMJ Books. p. 63.
- Ferro, JM; Fonseca, AC (2014). "Infective endocarditis.". Handbook of clinical neurology 119: 75–91.
- Murdoch, DR; et al. (9 March 2009). "Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century: the International Collaboration on Endocarditis-Prospective Cohort Study". Archives of Internal Medicine 169 (5): 463–73.
- Topics in Infectious Diseases Newsletter, August 2001, Pseudomonas aeruginosa.
- Gold, JS; Bayar, S; Salem, RR (July 2004). "Association of Streptococcus bovis bacteremia with colonic neoplasia and extracolonic malignancy". Archives of surgery (Chicago, Ill. : 1960) 139 (7): 760–5.
- Chew SSB, Lubowski DZ (2001). "Clostridium septicum and malignancy". ANZ Journal of Surgery 71 (11): 647–649.
- Mirabelle Kelly, MD (June 7, 2005). "HACEK Group Infections".
- Lamas, CC; Eykyn, SJ (March 2003). "Blood culture negative endocarditis: analysis of 63 cases presenting over 25 years". Heart 89 (3): 258–262.
- Clayton, JJ; et al. (August 2006). "Endocarditis caused by Propionibacterium species: a report of three cases and a review of clinical features and diagnostic difficulties". Journal of Medical Microbiology 55 (8): 981–987.
- Brusch J. Infective Endocarditis: Management in the Era of Intravascular Devices. New York, NY: Informa Healthcare; 2007.
- Xiong YQ, Fowler VG, Yeaman MR, Perdreau-Remington F, Kreiswirth BN, Bayer AS. Phenotypic and genotypic characteristics of persistent methicillin-resistant Staphylococcus aureus bacteremia in vitro and in an experimental endocarditis model. J Infect Dis. 2009 Jan 15. 199(2):201-8.
- Chu VH, Miro JM, Hoen B, Cabell CH, Pappas PA, Jones P, et al. Coagulase-negative staphylococcal prosthetic valve endocarditis--a contemporary update based on the International Collaboration on Endocarditis: prospective cohort study. Heart. 2009 Apr. 95(7):570-6.
Kata Kunci Pencarian : Endokarditis Infektif,
Karya Tulis Ilmiah, Makalah, Jurnal, Artikel, Kardiologi, Referat, SKP (Satuan Kredit Profesi), Kompetensi, pdf, word, .pdf, .doc, .docx, Ilmu
Penyakit Dalam, Tesis, Skripsi, Desertasi, refrat,modul BBDM, Belajar Bertolak Dari Masalah, Problem Based Learning, askep, asuhan keperawatan
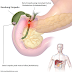
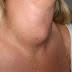




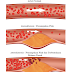



0 comments:
Posting Komentar